![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
93 Cards in this Set
- Front
- Back
|
Tensión Superficial |
Cantidad de energía que se requiere para incrementar la superficie del líquido por unidad de área. |
|
|
Punto de ebullición |
Temperatura ala, cual un líquido hierve |
|
|
Densidad |
Relación que existe entre la masa y el volumen |
|
|
Sólidos |
Oponen resistencia a cambios de forma y volumen. |
|
|
Ley de gay lussac |
A volumen constante la presión es directamente proporcional a su temperatura en escala Kelvin |
|
|
Ley de las presiones de Dalton |
La presión total ee la mezcla es la suma de las presiones parciales de todos los gases |
|
|
Punto de congelación |
Temperatura ala cual una sustancia en estado líquido pasa a solidificarse |
|
|
Estado líquido |
Considerado un fluido con un volumen determinado su forma es definida por el contenedor. |
|
|
Ley de Charles |
A presión constante el volumen de gas es directamente proporcional a su temperatura. |
|
|
Robert boyle |
Considerado el padre de la química moderna |
|
|
El abate edme mariotte |
Formuló con mayor precisión la ley de boyle con la ley de compresibilidad de los gases: A temperatura constante el volumen de un gas varía en razón inversa a su presión. |
|
|
Ley de Charles |
A presión constante y para una masa dada de un gas el volumen del gas es directamente proporcional a su temperatura absoluta. Formula V1/T1=V2/T2 |
|
|
Ley de gay lussac |
A volumen constante la presión de una masa fija de un gas es directamente proporcional a su temperatura en la escala Kelvin. Formula P/T=constante |
|
|
Ley de las presiones parciales de Dalton |
La presión total en la mezcla es la suma de las presiones parciales de todos los gases. |
|
|
Ley General de los gases ideales |
Los volumen ocupados por una misma masa gaseosa son directamente proporcionales a las temperaturas absolutas correspondientes e inversamente proporcionales a sus presiones. Formula PV= n R T |
|
|
Ley de boyle |
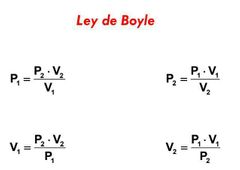
|
|
|
Ley de Charles |

|
|
|
Ley de Gay-Lussac |
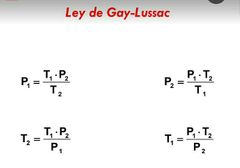
|
|
|
Ley General de los gases |
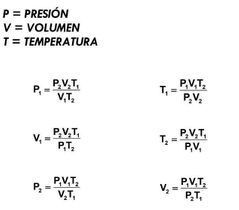
|
|
|
Materia |
La materia es todo lo que ocupa un lugar en el espacio. |
|
|
Densidad |
Es una magnitud intensiva es decir que no depende dela cantidad de sustancia o del tamaño de un sistema. Se expresa p=m/v |
|
|
Densidad |
La densidad es inversamente proporcional al volumen y directamente proporcional a la masa. |
|
|
Teoría de las colisiones |
Propuesta por Max trautz y william lewis Explica cómo ocurren las reacciones químicas Y cómo son las velocidades para cada tipo de reacción. |
|
|
Isótopo |
son átomos que tienen el mismo número atómico, pero diferente masa atómica. Es decir, contienen el mismo número de protones pero difieren en el número de neutrones. |
|
|
1662 Robert Boyle |
Establece las leyes de los gases ideales. |
|
|
1789 Antoine Lavoisier |
Establece las leyes de conservación de la materia. |
|
|
1896 Henri Becquerel |
Descubre la radio actividad. |
|
|
J.J Thompson |
Descubre el electrón. |
|
|
1928 Alexander Flemming |
Descubre el primer antibiótico, la penicilina |
|
|
1932 James Chadwick |
Descubre el neutrón. |
|
|
Materia |
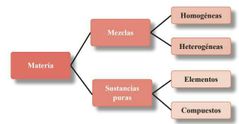
|
|
|
sustancia pura |
Es un material que siempre tiene la misma composición y cuyas propiedades físicas y químicas no varían (como el color, la densidad, el punto de ebullición, entre otras). Las sustancias puras se clasifican en elementos y compuestos. |
|
|
Elementos |
son las sustancias puras más simples. |
|
|
Metabolismo: |
Son todas las reacciones quí-micas que se llevan a cabo dentro de un ser vivo. |
|
|
¿Qué enuncia la ley de la conservación de la energía? |
La ley de la conservación de la energía afirma que la cantidad total de energía en cualquier sistema físico aislado permanece invariable con el tiempo, aunque dicha energía puede transformarse en otra forma de energía. |
|
|
¿Cuál es la ley equivalente para la conservación de la materia? |
ley de Lomonósov-Lavoisier nos indica que: La masa no se crea ni se destruye, solamente se transforma. |
|
|
¿A qué se le llama estado de agregación? |
Los estados de un material depende de las condiciones de presión y temperatura. |
|
|
Elementos |
son las sustancias puras más simples. Un elemento se caracteriza por tener átomos de un mismo tipo. Los elementos pueden ser de tres tipos: metales, no metales y metaloides. |
|
|
Compuestos |
son sustancias puras que se obtienen como resultado de la combinación química de dos o más elementos diferentes. Los compuestos presentan fórmulas químicas definidas, por ejemplo el agua (H2O), el amoniaco (NH3), la sal de mesa (NaCl) entre otros. |
|
|
Mezcla |
son combinaciones físicas de sustancias puras, las cuales tienen composición variable. |
|
|
ISÓTOPOS |
Los átomos de un mismo elemento, que tienen igual número de protones y electrones (igual número atómico) pero diferente numero de neutrones. |
|
|
Cambios de estado de la materia. |
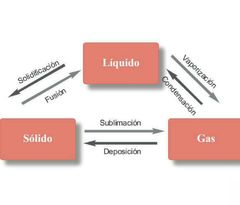
|
|
|
Energía: |
Capacidad para realizar trabajo o transferir calor. |
|
|
Energía potencial |
es la que tienen los objetos debido a su posición. Pertenecen a esta categoría la energía química y la nuclear. Otros ejemplos de energía potencial son: la que tiene el agua almacenada en una presa y la de un resorte comprimido o estirado. |
|
|
Energía cinética |
es la que tienen los cuerpos debido al movimiento. Pertenecen a esta categoría: la energía eléctrica (movimiento de electrones), la energía calorífca (movimiento de moléculas), la energía luminosa (movimiento de ondas electromagnéticas) y la energía mecánica (movimiento de las piezas de una máquina). |
|
|
Aportaciones históricas de los modelos atómicos. |
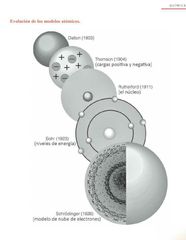
|
|
|
Maleabilidad: |
Capacidad de un metal para cambiar de forma cuando se martilla o se lamina para formar placas delgadas. |
|
|
Ductabilidad: |
Capacidad de un metal de ser estrado (alargado) para formar alambres. |
|
|
Radio atómico. |
El radio atómico se define como la distancia comprendida entre el centro del núcleo y el nivel externo del átomo. |
|
|
Anión: |
Ion con carga negativa. |
|
|
Catón: |
Ion con carga positiva. |
|
|
Ácidos. |
Un ácido se define como una sustancia que produce iones hidrógeno (H+) cuando se encuentra disuelto en agua, es decir, cuando está en forma de solución acuosa. |
|
|
Bases o Hidróxidos. |
Compuestos ternarios que resultan de la combinación de un óxido metálico con agua. También reciben el nombre de bases o álcalis, que significa cenizas. |
|
|
Oxidación: |
Proceso químico en el que hay pérdida de electrones. |
|
|
Calor: |
es la transferencia de energía térmica desde un sistema a otro de menor temperatura. La energía térmica puede ser generada por reacciones químicas (como la combustión), reacciones nucleares (fusión nuclear), disipación electromagnética (hornos microondas). |
|
|
Reacciones exotérmicas |
son las que liberan calor hacia sus alrededores, hacia el medio ambiente. En estas reacciones el calor se considera como uno de los productos de la reacción, ejemplo la combustión del gas butano, que produce dióxido de carbono, agua y desprendimiento de calor. |
|
|
Reacciones endotérmicas |
son las que absorben calor de sus alrededores, del medio ambiente, en estas reacciones el calor se considera como uno más de los reactivos, ejemplo la descomposición del agua. |
|
|
Entalpía. |
Esta palabra proviene del griego enthalpien, esto signifca calentar y se representa por la letra H. La entalpía es el calor de una sustancia a presión constante, es una magnitud de termodinámica. |
|
|
La combustión. |
La combustión es el proceso químico por el cual una sustancia, llamada combustible, reacciona con el oxígeno. En general, esta reacción es fuertemente exotérmica, desprendiéndose energía en forma de calor, luz o sonido. |
|
|
La combustión del carbono. El producto es dióxido de carbono y se desprende energía lumínica y calorífca. Cuando esta reacción tiene lugar con poco oxígeno, se forma monóxido de carbono, un gas Ivenenoso y muy peligroso. ■ La combustión de hidrocarburos (compuestos cuya base es carbono e hidrógeno). En esta reacción se forma CO2 y vapor de agua. Es la reacción que tiene lugar en la combustión de los combustibles fósiles (carbón y petróleo). ■ La combustión de la glucosa en el cuerpo humano. La glucosa, procedente de la digestión de ciertos alimentos o de la transformación de otras sustancias, reacciona con el oxígeno presente en las células, produciendo CO2 , agua y liberando energía. Esta reacción es lo que se conoce como respiración metabólica. |
Y |
|
|
Es todo lo que tiene masa y posee inercia: |
Materia |
|
|
Combinación de dos o más sustancias que conservan sus propiedades y que se puede separar por medios físicos. Pueden ser homogénea o heterogéneo. |
Mezcla |
|
|
La fórmulas de H2SO4 HBr,H2CO3 porque llevan hidrógeno al principio son ejemplos de: |
Ácidos |
|
|
Las fórmulas de NaCIO3,Ca2,SO4 por tener tres letras mayúsculas se clasifican como: |
Temarios |
|
|
Las fórmulas de CO2,PO4,AI2O3 se escriben con dos letras mayúsculas y el segundo elemento es oxígeno, por lo que se clasifican como: |
Óxidos |
|
|
Las fórmulas del KOH,NaOH,Pb(OH)2 por llevar OH al final se clasifican como: |
Bases |
|
|
Redescubrió las ideas atomísticas de Democrito, y propuso un modelo descriptivo de la materia, que es el primer modelo atómico. |
Dalton |
|
|
Descubre que a través de su modelo de budín como pasa,que el átomo posee cargas negativas(electrones) incrustadas en una esfera. |
Thomson |
|
|
Partícula del átomo con carga positiva y se encuentra dentro del núcleo. |
Protón |
|
|
Nomenclatura: |
Existen 4 compuestos inorgánicos |
|
|
OXIDOS (terminan con O) |
•óxidos metálicos o básicos (oxígeno + metal) Se pone la palabra "óxido" + de "nombre del metal". Ejemplo: CaO = óxido de calcio. •óxidos no metales o anhídrido ( oxígeno + no metal) Se pone el prefijo ( mono,di,tetra,penta,etc). + la terminación óxido, + " de", + el nombre del no metal. Ejemplo: NO2 = dióxido de nitrógeno o N2O3 = trióxido dinitrógeno |
|
|
Hidróxidos ( terminan en "OH")
|
Se pone la palabra "hidróxido", + " de", + el nombre del metal. Ejemplo: KOH = hidróxido de potasio. |
|
|
Ácidos (inicia con "H") |
•Ácidos binarios o hidrácidos (no tiene oxígeno) Se pone la palabra "ácido" + raíz del no metal (flúor,clor,brom,yod,sulf,nitr,o fost) + terminación "hídrico" Ejemplo: HCl= (ácido clorhídrico)
•Oxiacidos o ácidos ternarios ( tienen oxígeno) Se pone la palabra "ácido" + el ion poliatómico cambiando la terminación Ato por ico y la terminación ito por oso Ejemplo: HNO3 = ácido nítrico Ejemplo: HNO2= ácido nitroso
|
|
|
Sales |
•Sales binarias ( no tiene oxígeno) Se pone la raíz de no metal + terminación "uro" + "de" + el nombre del metal Ejemplo: NaF= floruro de sodio. •Oxisales o sales ternarias (tienen oxígeno) Se pone el nombre del ion poliatómico + "de" + el nombre del metal Ejemplo: KNO3= nitrato de potasio |
|
|
Conceptos básicos |
Mezclas •Mezclas homogéneas: Son aquellas donde no se distinguen sus componente ( licuado,pared,coca cola,etc). • Mezcla heterogénea: Son aquellas donde se pueden ver sus componentes (ensalada,pico de gallo,agua con aceite,etc). |
|
|
Compuesto: dos o mas elementos distintos Es una sustancia formada por la combinación de dos o mas elementos distintos de la tabla periódica. |
Mol Es la unidad en la que se mide la cantidad de una sustancia ( elemento o compuesto químico) |
|
|
Cambios que presenta la materia •Fisicos: Cambian de forma,tamaño o estado de agregación. Ejemplos: romper un papel,estirar una liga,evaporar agua,etc. •Quimicos: Se forman nuevas sustancias. Ejemplos: Quemar un papel ( combustión), la oxidación de un metal,asar carne,etc. •Nucleares: modifican en núcleo del átomo. Ejemplos: la bomba atómica (fusión),y la formación del helio en el sol ( fusión). |
Tipos de reacción: |
|
|
Estados de agregación de la materia |
La materia se encuentra en 4 estados de agregación: líquido, gaseoso,sólido, plasma. La materia se presenta en 6 estados: evaporación (líquido a gas), Condensación ( gas a líquido), Solidificación (liquido a sólido), fusión ( solido a líquido), Sublimación ( solido a gas), y sublimación inversa ( gas a solido). |
|
|
Alotropo: Son moléculas formadas por un solo elemento y que poseen distinta estructura molecular. Ejemplo: carbono ( diamante, grafito) |
Isótopo: Son átomos con un mismo número atómico pero cantidad diferente de neutrones. Ejemplo: carbono(12,13,14). |
|
|
Leyes de individuales de loa gases |
Ley de boyle • La presión de un gas es inversamente proporcional al volumen. Ejemplo: Un globo al ir subiendo se va inflado debido a que mientras más se sube,va disminuyendo la presión. |
|
|
Ley de Charles: • El volumen es directamente proporcional a la temperatura. Ejemplo: Al dejar una pelota al sol se infla debido a que aumenta la temperatura. |
Lay de Gay- Lussac: • La presión es directamente proporcional a la temperatura. Ejemplo: Un aerosol explota al exponerlo al fuego debido a su alta presión al aumentar su temperatura. |
|
|
Ley de las proporciones definidas (proust) peso Cuando dos elementos se combinan para formar un determinando compuesto lo hacen en una relación de peso constante independientes del proceso seguido para formarlo. |
Ley de las proporciones múltiples (dalton) Las cantidades de un mismo elemento,que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto, están en relación de números pequeños enteros. Compuestos distintos |
|
|
Las bases tienen un radical |
OH Base= radical hidróxido |
|
|
Principio de Arquímedes |
El principio de Arquímedes afirma que todos los cuerpos sumergidos en un fluido experimenta un empuje vertical y hacia arriba igual al peso de fluido desalojado. |
|
|
Se puede decir que en el proceso de oxidación de un metal este: |
Perder electrones |
|
|
Los elementos llamados metales son aquellos que: |
Al combinarlos con el oxígeno dan óxidos |
|
|
Los átomos que tienen el mismo numero de atómico pero diferentes,número de neutrones se llaman: |
Isótopos |
|
|
Un hidrocarburos de una cadena abierta es aquel que está formado: |
De carbono sonidos en una línea recta |
|
|
Digan si en las sustancias químicas puras la proporción entre los elementos qué la componen : |
Siempre constante |
|
|
Se puede decir que lo que ocurre en un enlace covalente: |
Dos o más elementos comparten electrones |
|
|
Enlaces químicos: |
•Enlace iónico: se lleva a cabo entre Metal+ No metal. -Los metales pierden electrones y loa no metales los ganan. Ejemplo: Nacl = cloruro de sodio. |
|
|
Enlace covalentes: Se lleva a cabo con un No metal + No metal - Se realiza compartiendo partes de electrones. Existe dos tipos de enlaces covalentes, El polar se realiza entre dos no metales diferentes ( ejemplo HCl) y el No Polar entre dos no metales iguales ( ejemplo: O2). |
Enlace metálico: Se lleva a cabo entre metal + metal Lo encontramos en ventanas,puertas,monedas y en cualquier estructura metálica o bien,formando aleaciones como el acero (Fe+Cl),bronce(Cu+Sn),amalgamas dentales (Hg+Ag). |
|
|
Energía En la capacidad de realizar un trabajo. La energía se clasifica en potencial y cinética. |
•Energía potencial: Energía en reposo(una batería,el aire |

