![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
47 Cards in this Set
- Front
- Back
|
Onda |
Alteración vibrátil mediante la cual se transmite la energía |
|
|
Propiedades de las Ondas |
1. Longitud de Onda 2. Frecuencia 3. Amplitud |
|
|
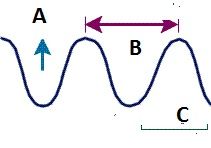
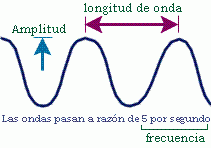
Longitud de onda |
Representado por A (lambda). Es la distancia entre dos puntos identicos de ondas sucesivas |
|
|
Frecuencia de onda |
Representado por V (nu). Numero de ondas que atraviesan un punto particular |
|
|
Amplitud de onda |
Es la longitud vertical de la línea media de una onda a su cresta o su valle |
|
|
Onda elecctromágnetica |
Tiene como componente un campo eléctrico y otro mpagnetico |
|
|
|
|
|
Rapidez de la luz se define como... |
Rapidez de las ondas electromágneticas |
|
|
El problema del cuerpo negro |
La naturaleza ondulatoria de la luz no explica por qué un cuerpo brilla cuando su emperatura aumenta. Mark Planck dijo que la energía existe como paquetes llamados cuantos. |
|
|
Fórmula para buscar la energía |
E= hv (h es constante de plank y v es frecuencia) E= hc/A (c es la luz en el vacío y A es la longitud de la onda) |
|
|
La luz en el vacío tiene una rapidez de... |
3.00 x 10¨8 m/s |
|
|
Constante de Plank
|
6.63 x 10¨-34 J/s |
|
|
Cuantos |
Mínima cantidad de energía que se puede emitir o absorber en forma de radiación |
|
|
Efecto Fotoeléctrico |
Fenómeno en el que los electrones son expulsados dedsde la superficie de ciertos metales que se han expuesto a la luz al menos determinada frecuencia mínima, y se conoce como frecuencia umbral |
|
|
¿Qué dedujo Einstein respecto al efecto fotoélecctrico? |
Tomando como punto de partida la teoría cuántica de Planck, Einstein dedujo que (simbolo raro de fania) de estas partículas de luz, que ahora se conocen como fotones, deben poseer una energía E de acuerdo a la ecuación: E = hv |
|
|
¿Qué significa que la luz es de naturaleza dual? |
Que posee ambas propiedades: se comporta como onda y como partícula |
|
|
Teoría de Bohr |
1) Los electrones en el atomo solo pueden ocupar ciertas orbitas de energía. 2) La energía solamente se emite o se absorbe para mover un electrón de un estado de energía permitido a otro. 3) La energía absorbida o emitida cuando un electron pasa de un nivel energético a otro se calcula con la fórmula: E= -Rh [ (1/nf¨2) - (1/ni¨2) ] Donde Rh es la constante de Rydberg, nf es el nivel final y ni es el nivel inicial del electrón |
|
|
Constante de Rydberg (Rh) |
2.18 x 10¨-18 J |
|
|
Principio de Incertidumbre o Principio de Heinsenberg |
Mientras mejor conocemos el momento de una partícula menos conocemos su posición, es decir, no podemos conocer la posición y velocidad de un electrón |
|
|
Número cuántico n |
n = distancia del e- al nucleo. A mayor valor de n, mayor energía tiene el electrón. |
|
|
Número cuántico l |
l = # cuántico del momento angular: S= 0 P = 1 D = 2 F = 3 |
|
|
Número cuántico ml |
ml= # cuántico magnético y define la orientación del orbital
S = 1 (0) P = 3 (-1,0,1) D = 5 (-2,-1,0,1,2) F = 7 (-3,-2,-1,0,1,2,3) |
|
|
Número cuántico ms |
ms = # cuántico de espin electrónico, tiene dos sentidos de rotación: -1/2 y 1/2 |
|
|
Principio de Exclusión de Pauli |
Dos electrones en el mismo átomo no pueden tener los 4 números cuánticos iguales. |
|
|
Configuración Electrónica |
Distibución de todos los electrones de un átomo |
|
|
Diagrama de Orbital |
Se usa para hallar a ml y ms |
|
|
Diamágnetico |
Es cuando las flechas de spinnes están todos apareados. Son atraidos por imanes |
|
|
Paramángtico |
Es cuando las flechas de spinnes no están todos apareados. Son repelidos por imanes |
|
|
Densidad Electrónica |
Probabilidad de encontrar al electrón en una región dada en el espacio |
|
|
Orbital |
Región del espacio donde es más posible encontrar el e- |
|
|
Regla de Hund |
La distribución electronica más estable en los subniveles es la que tiene mayor numeros de spinnes paralelos |
|
|
Principio de Aufbau (construcción) |
Establece que cuando los protones se incorporan al nucleo de uno en uno para construir los elementos, los electrones se suman de la misma forma a los orbitales atómicos |
|
|
PROBLEMA: Si la frecuencia del fotón es de 6.0 x 10¨4 Hz, al convertir esta frecuenncia en logitud de la onda (nm) ¿ Se encuentra en la región visible? |
Fórmula a usar: C = AY |
|
|
PROBLEMA: Cuando el cobre se bombardea con electrones de alta energía, se emiten rayos X. Calcule la energía (en Joules) asociada a los fotones si la longitud de la onda de los rayos X es de 0.154 nm |
Fórmula a usar: E = hC/A |
|
|
Nodos |
Zonas de densidad electrónica Cero |
|
|
PROBLEMA Calcule la longitud de la onda en nm de un foton emitido por un atomo de hidrógeno durante la transición de su electrón del estado n=5 al estado n=3 |
Fórmula a usar: E= -Rh [ (1/nf¨2) - (1/ni¨2) ] |
|
|
PROBLEMA ¿Cuál es la longitud de la onda de Broglie en nm relacionado con na pelota de ping pong de 2.5 g viajando a 15.6 m/s? |
Fórmula a usar: A = h/mV |
|
|
PROBLEMA ¿Cuántos electrones pueden colocar en el subnivel 3d? |
No hay fórmula dude, sea inteligente |
|
|
Realiza la configuración electrónica de Z= 60 y di si es paramágnetico y diamágnetico |
HAGALO COÑAZO |
|
|
Afinidad Electrónica (AE) |
- valor negativo del cambio de energía que se desarrolla cuando un átomo, enestado gaseoso, acepta un electrón para formar un anión. - La afi nidad electrónica es positiva si lareacción es exotérmica y negativa, sila reacción es endotérmica. - Aumenta de izquierda a derecha |
|
|
Carga nuclear efectiva (Zefect) |
es lacarga nuclear detectada por un electrón cuando se toman en cuenta tanto la carga nuclearreal (Z) como los efectos repulsivos (pantalla) de los demás electrones. Zefect = Z - 0 donde 0 es la constante a apantallamiento |
|
|
Radio Atómico |
es la mitad de la distancia entre los núcleos de dos átomos metálicos adyacenteso de una molécula diatómica. |
|
|
Electrones de valencia |
electrones que ocupan el nivel de energía externo. |
|
|
Electrones de Kernel |
Todos los electrones que no son de valencia en un átomo |
|
|
Energía de Ionización |
la energía mínima (en kJ/mol) necesaria pararemover un electrón de un átomo en estado gaseoso, en su estado fundamental. Aumenta hacia arriba y de derecha a izquierda I.1 + X.(g) --> X¨+ + e- |
|
|
Radio Ionico |
el radio de un catión o un anión. |
|
|
Relaciones diagonales |
semejanzas queexisten entre pares de elementos de diferentes grupos y periodos en la tabla periódica |

